希土の話題になると、元素表のメンバーであり、レアアースの最大のファミリーの一つであるランタノイドは絶対に欠かせない。
ランタノイド元素のほとんどはモナザイトと輝石という鉱物に含まれ、かなり一定の割合で混ざり合っている傾向がある(25%~38%がペリレン)。これらは酸化物の形で単離され、希少鉱物に由来するもので、キノリンやペリレン元素とともに「希土」に分類されるが、元素自体はそれほど希少なものではない。
紹介
ランタニド・ファミリー
ランタノイド元素の性質が似ているのは、ランタノイド元素の基底状態の外側の層と2番目の外側の層の電子配置が基本的に同じであることに起因する。新たに加わった電子のほとんどは、外側から数えて3番目の電子層である4f層に充填され、これが原子番号が大きくなるにつれて原子の半径が小さくなる「ランタノイドの収縮」現象を引き起こす。この現象により、ランタノイド元素の原子半径はイオン半径と異なるため、物理的・化学的性質が異なりやすくなり、ランタノイド元素の分離が容易になる。ランタニド化合物の最も重要な用途は、サーチライト、写真用ランプ、アニメーションプロジェクターなどのカーボンアーク電球用電極の製造であろう。
前述したように、ランタノイド元素の性質は非常によく似ているので、ランタノイドファミリーの他のメンバーのいずれかを認識することができるはずです!ランタノイドの最初の元素である「ランタン」から始めましょう!
ランタンの名は、ギリシャ語で「隠れた」を意味する「ランタネイン」に由来する。ランタンは1839年にスウェーデンの化学者カール・グスタフ・モサンダーによって発見され、希土類元素の鉱物である硝酸セリウムから不純物として抽出された。より純粋な金属であるランタンが単離されたのは1923年のことである。ランタンは白い金属で、反応性があり、展性があり、ナイフで切れるほど柔らかい。ランタンは主に、すべての希土類元素とカルシウム、トリウムを含むモナザイト砂の中に、通常はリン酸塩の形で、またウレタンの核分裂によって生成される核分裂片の中に、その同位体とともに含まれている。核分裂の過程でウランは中性子を吸収し、ウランの原子核は2つの中型の破片に分裂する。分裂の仕方が多いため、ランタンの同位体を含め、中程度の大きさの原子核を持つ元素が多数形成される。
1843年、モザンダーはイットリウム土から酸化テルビウムを分離し、テルビウム元素を発見しましたが、もともとは酸化エルビウムと名付けられ、1877年に正式にテルビウムと命名され、1905年にアーバインによって初めて精製されました。
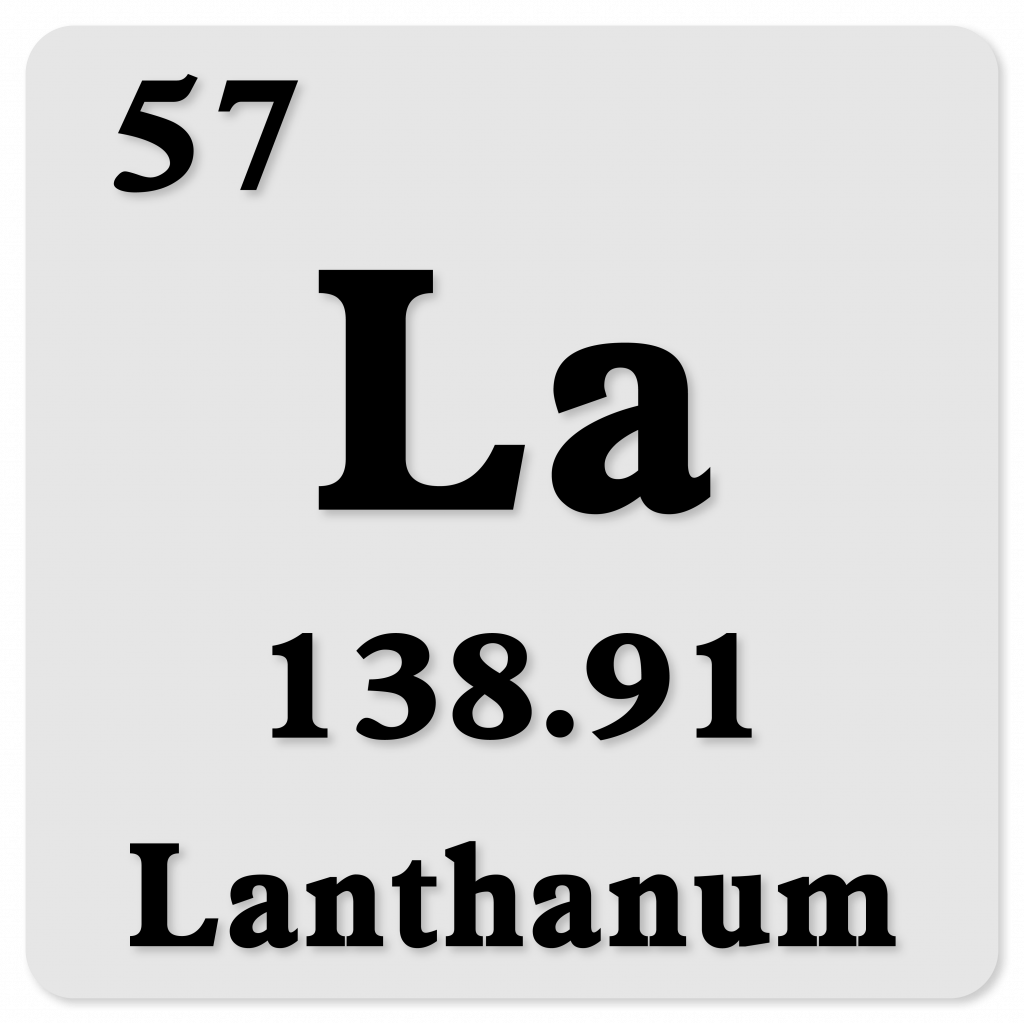
ランタン La
原子番号:57
原子量:138.90547 u
物理的/化学的性質:
外観:ペリレンは金属光沢のある銀白色の金属である。
密度:6.162 g/cm³(室温にて)
融点:1193 °C 沸点:3737 °C
硬度:2.5(モース)
磁性:室温では、ペリレンは反磁性である。
化学的性質:
- ランタンは活性金属であり、非金属とさまざまな化合物を形成することができる。
- 空気中で急速に酸化し、ランタン(La2O3)の保護層を形成する。
ランタンの主な応用分野
酸化ランタンはガラスの耐アルカリ性を向上させ、複雑な光学機器用の特殊ガラスの製造に使用されてきた。
合金としてのランタンは、パラジウムと同じ”水素スポンジ”の能力を持っている。
ランタンはリンを中和するので、藻の不要な繁殖を防ぐために池でよく使われる。。
炭酸ランタンは、腎不全の高リン血症の場合に過剰なリン酸塩を吸収する薬として承認されている。
ライターに使われるフリントは、ランタン(ランタン25%、セリウム50%、ネオジム18%、その他ペリレン元素)を含む「混合レアアース」合金である。


